



2021年12月10日,bevictor伟德官网、上海市调控生物学重点实验室、bevictor伟德官网医学合成生物学研究中心叶海峰课题组在国际著名学术期刊《科学—进展》(Science Advances)在线发表了题为 A far-red light–inducible CRISPR-Cas12a platformfor remote-controlled genome editingand gene activation 的研究论文,报道了一种远红光调控的基因编辑和表观遗传重塑的控制系统,为精准可控的基因编辑技术再添一员大将。这是继2020年7月开发的光控基因编辑工具FAST系统之后(Yuetal, Science Advances, 2020),开发的另一种全新版本。

Science Advances刊发叶海峰课题组成果
CRISPR-Cas系统是存在于细菌和古细菌中的一种免疫系统,其能对靶基因进行有效的切割、插入以及激活(1)。CRISPR基因编辑技术正在给予人类以重新改写生命密码的“神力”,在生物医学,健康等领域具有巨大的商业前景。该技术也因此斩获2020年诺贝尔化学奖。CRISPR-Cas12a是II类V型基因编辑工具,由于其系统相对简单,只需要crRNA协助识别靶基因、偏好识别T富含的基因序列、较低的脱靶效率及相对较小的蛋白分子量等优点引起了生物学界的广泛关注(2)。然而,CRISPR基因编辑工具由于不可控性导致的脱靶效应及潜在风险极大地限制了其体内应用,能否给它带上枷锁,控制其发挥活性的时间、空间和地点,甚至使其活性控制做到剂量依赖,从而实现更加精准的基因编辑。目前,远程、无痕、精准可控的CRISPR-Cas12a还鲜有报道。
为了解决基因编辑精准控制问题,叶海峰团队结合光遗传学及合成生物学设计理念,以先前开发的远红光调控的转基因表达系统为基础(3),开发了远红光调控的CRISPR-Cas12a基因编辑系统及CRISPR-dCas12a基因激活系统,为Cas12a安装了一个精准可控的开关,实现了靶基因的精准切割或者激活。
研究人员首先设计了远红光调控的CRISPR-Cas12a基因编辑系统(简称FICA),其设计原理如下图所示,远红光作为基因开关可以精准调控Cas12a的表达,在crRNA的帮助下,现了对多种基因的高效切割。
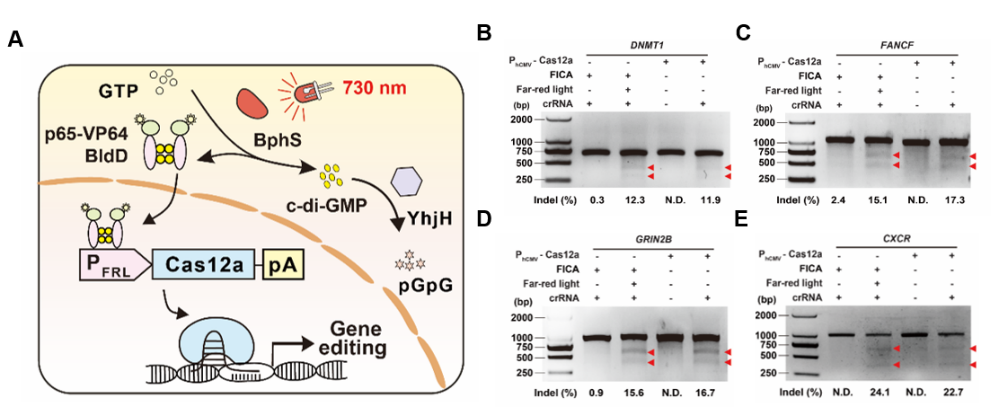
FICA设计原理及对多种基因的光控编辑
接着,研究人员通过利用SunTag技术,开发了远红光调控的CRISPR-dCas12a基因激活系统(简称FIdCA)。利用该系统,研究人员成功实现了对内源基因HBB的高效激活。随后,研究人员将FIdCA系统通过尾静脉递送至小鼠体内,成功在小鼠体内实现了远红光诱导靶基因激活。
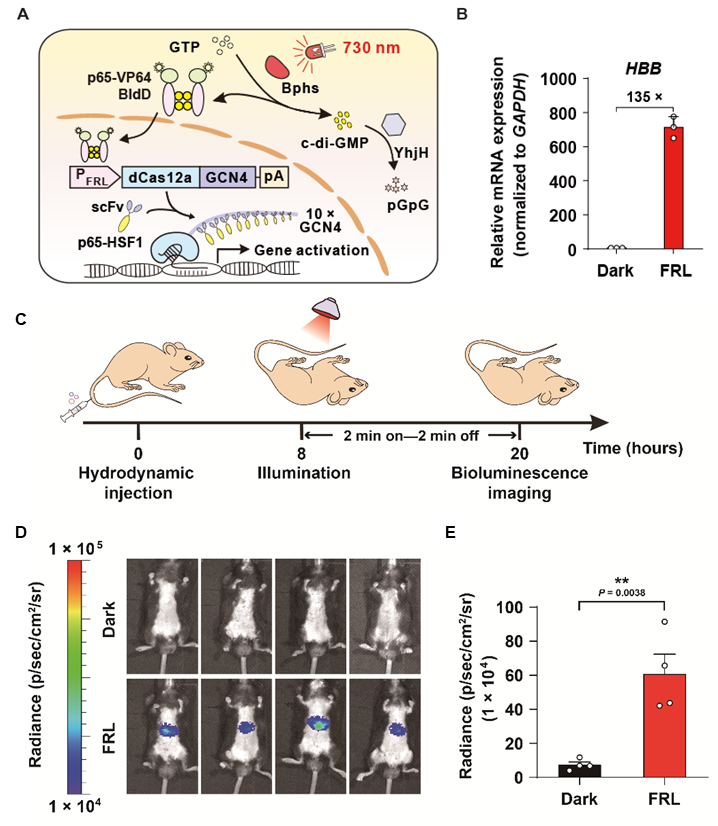
FdICA设计原理及在小鼠体内激活靶基因表达
总之,该研究以无毒副作用、组织穿透能力强的远红光作为激发开关,实现了远红光介导的基因编辑和基因激活,为可控基因编辑和表观遗传操控提供了新方法和新工具,为精准可控的基因治疗和细胞治疗奠定了基础,进一步推动了光遗传学技术在精准医学领域的应用研究。

论文第一作者2020级博士研究生王欣怡
该论文的第一作者为2020级博士研究生王欣怡。论文通讯作者为bevictor伟德官网王美艳副研究员和叶海峰研究员。该研究受到了国家重点研发计划“合成生物学”重点专项、上海市科委合成生物学重大项目以及国家自然科学基金的大力支持。
论文链接:https://www.science.org/doi/10.1126/sciadv.abh2358
参考文献
1.L. Cong, F. A. Ran, D. Cox, S. Lin, R. Barretto, N. Habib, P. D. Hsu, X. Wu, W. Jiang, L. A. Marraffini, F. Zhang, Multiplex Genome Engineering Using CRISPR/Cas Systems.Science.339, 819-823 (2013).
2.B. Zetsche, J. S. Gootenberg, O. O. Abudayyeh, I. M. Slaymaker, K. S. Makarova, P. Essletzbichler, S. E. Volz, J. Joung, J. van der Oost, A. Regev, E. V. Koonin, F. Zhang, Cpf1 is a single RNA-guided endonuclease of a class 2 CRISPR-Cas system.Cell.163, 759-771 (2015).
3.J. Shao, S. Xue, G. Yu, Y. Yu, X. Yang, Y. Bai, S. Zhu, L. Yang, J. Yin, Y. Wang, S. Liao, S. Guo, M. Xie, M. Fussenegger, H. Ye, Smartphone-controlled optogenetically engineered cells enable semiautomatic glucose homeostasis in diabetic mice.Sci Transl Med.9, (2017).